|
Vitamine C 정량분석
비타민 음료수 내의 비타민 C 함량 분석
1. 이론
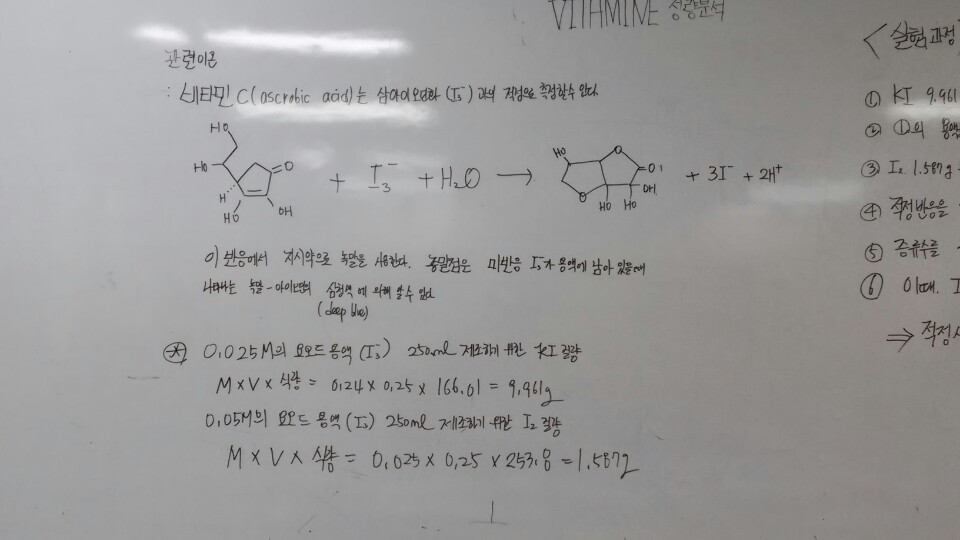
비타민 C (ascorbic acid) 는 삼아이오딘화 이온( I3- ) 과의 적정으로 측정할 수 있다.
이 반응에서 지시약으로 녹말을 사용한다. 종말점은 미반응 I³- 가 용액에 남아 있을 때 나타나는
녹말-아이오딘 착물의 심청색(deep blue)에 의해 알 수 있다.
2. 실험 방법
1) 적정시약(표준용액) 제조하기
(1) 적정 시약 : 0.025M의 요오드용액(I3
- 용액) 250mL
(2) 이론
요오드 용액 : I2 + I- (from KI) ⇄I3-
이론적 사용량 : I2 0.025mol, KI 0.24mol 를 증류수에 녹여 전체용액의 부피가 1L가 되도록 함.
: 전체 용액의 부피가 250mL일 경우, I2 0.025molx0.25x식량, KI 0.24molx0.25x식량
을 증류수에 녹여 전체용액의 부피가 250mL가 되도록 함.
(I2 의 용해도를 증가시키기 위해 KI를 과량으로 사용)
이 용액의 평형상태에서의 I3
- 농도는 0.025M 임.
녹말여 심청색을 나타냄.
(3) 준비시약 및 실험기구 :
- 시약 : I2(253.8 g/mol), KI(166.01g/mol), 증류수, 녹말 용액
- 실험기구 : 음료수(비타500) 뷰렛, 비커, 스포이드, 녹말물, 요오드 용액지시약 : 1%(wt/wt)
(4) 제조절차
① 0.025M의 요오드용액(I3
- 용액) 250mL제조하기 위한 KI 질량
= M x V x 식량 = 0.24 x 0.25 x 166.01 = 9.961g
0.05M의 요오드용액(I3
- 용액) 250mL제조하기 위한 I2 질량
= M x V x 식량 = 0.025 x 0.25 x 253.8 = 1.587g
② KI 9.961g 무게를 측정한 후, 비이커에 넣고 증류수 100mL로 녹인다.
③ ②의 용액을 250mL 부피플라스크에 넣는다.
④ I2 1.587g 무게를 측정한 후, KI 용액이 있는 250mL 부피플라스크에 넣는다.
⑤ 적정 반응을 촉진시키기 위해 촉매인 진한 염산을 2-3방울 넣는다.
⑥ 증류수를 눈금선까지 채운다.
⑦ 이때, I2가 잘 녹지 않으므로, 부피플라스크에 magnetic bar를 넣고, 상온에서 교반한다.
⑧ I2가 다 녹은 것이 확인되면 적정시약의 준비가 완료된 것이다.
2) 비타민 음료 희석하기
- 비타민 음료(이하, sample) 10%(wt/wt) 용액 제조
: sample 10mL를 취해 (10mL hole pipet 이용) 100mL 부피플라스크에 넣고, 증류수로 눈금선까지
채운다.
3) 적정할 sample 준비하기
(1) 2.에서 제조한 10% sample 용액 25mL를 취해 비이커에 넣는다.
(2) 10% sample 용액 25mL 속에 용해되어 있는 sample의 양은 2.5mL(25mL x 0.1(from10%))에
해당한다.
(3) 여기에 녹말 지시약을 2mL 를 첨가한다.
(4) magnetic bar를 넣는다.
4) 적정 준비하기
(1) 실험전 washing된 건조된 뷰렛을 설치한다.
(2) 뷰렛에 적정시약인 요오드 용액을 넣는다.
(3) 적정의 정확성을 높이기 위해 처음 요오드 용액은 배출시켜 버린다.
5)적정하기
(1) 교반기를 이용 sample을 교반하면서 적정을 실시한다.
(2) 적정하면서 sample 용액의 색이 심청색으로 변화하는 순간으로부터 종말점을 구한다.
(3) 종말점에서 적가된 요오드 용액의 부피로부터 sample내 비타민C 함량 (%(wt/vol))을 구한다.
① 10% sample 용액 25 mL 속에 들어 있는 sample의 양 = 2.5mL
② 2.5 mL sample 속에 들어 있는 비타민C 몰수 = 적가된 I3
-이온의 몰수
= M_I3
- x V_I3
-
= 0.025 x V_I3
-(= 적가된 요오드 용액 부피)
③ 2.5 mL sample 속에 들어 있는 비타민C 질량
= 2.5 mL sample 속에 들어 있는 비타민C 몰수 x 비타민C 분자량
④ 음료수내의 비타민 C % (wt/vol) = (2.5mL sample 속에 들어 있는 비타민C 질량/2.5mL) x 100
실험 결과 : 대부분의 조가 실험했을 때, 계산했을 때의 결과인 5.6ml에 근접하게 나왔음.
|