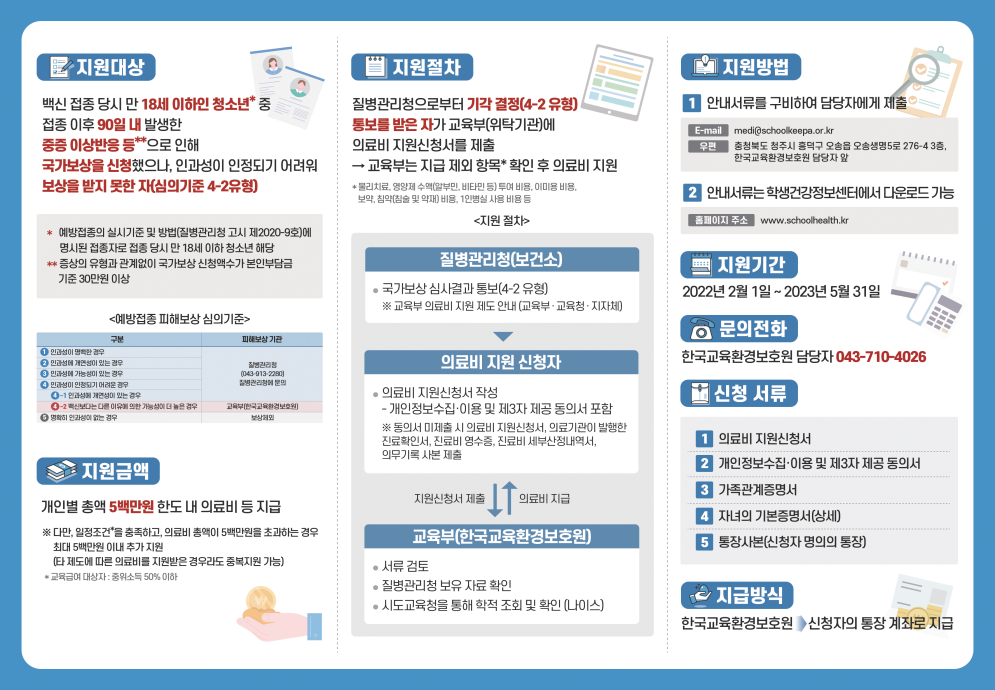
|
코로나19 예방접종 대응 추진단에서 22~23년 청소년(12~17세) 대상 [동절기 코로나 19 추가접종 계획]을 알려와 안내합니다. [ 동절기 코로나19 추가 예방접종 운영 개요 ] 1. 접종대상: 12~17세(05.01.01 ~10.12.31) 청소년 중 기초접종(2차) 이상 완료자 면역저하자 및 기저질환자 등 고위험군은 접종 권고
2. 활용백신: 화이자 BA.1 및 BA.4/5 기반 2가 백신 우선 활용 * 예외적으로 mRNA 백신 접종 금기 및 원하지 않는 경우 노바백스 백신으로 접종 가능
3. 시행일정: 2022.12.12. 사전예약 및 당일접종 시작, 2022.12.19 예약접종 시작 * 기존 단가백신을 활요한 청소년 3차접종은 사전예약(12.12.) 및 접종(12.17.)각각 중단하고, 2가백신을 활용한 추가접종으로 단일화함
4. 접종간격: 마지막 접종일로부터 3개월(90일)이후
5. 접종시행: 접종 당일 신분증 지참 후 보호자와 함께 방문, 예진표 작성 후 접종 (보호자 미동반 시 보호자가 사전 접종시행 동의서 및 예진표 작성) 



붙임 7 | | 식품의약품안전처 의약품상세정보 약물이상반응 |
구분 | 전달체 백신(바이러스 벡터) | 핵산 백신(mRNA) | 유전자 재조합 백신 | 아스트라제네카 | 얀센 | 화이자 (5-11세용) | 화이자 | 모더나 | 노바백스 | 스카이코비원 | 2021.2.10., 5.21 허가 | 2021.4.7. 허가 | 2022.2.23. 허가 | 2021.3.5. 허가 | 2021.5.21. 허가 | 2022.1.12. 허가 | 2022.6.29. 허가 | 매우 흔하게 (≥1/10) | 주사부위압통, 주사부위통증, 주사부위온감, 주사부위소양증, 주사부위 멍, 오심, 피로, 병감(권태), 오한, 두통, 열감(발열), 근육통, 관절통, | 주사부위통증, 오심, 피로, 근육통, 두통 | 주사부위통증, 주사부위종창, 설사, 피로, 오한, 발열, 관절통, 근육통, 두통 | 주사부위통증, 주사부위종창, 설사, 피로, 오한, 발열, 관절통, 근육통, 두통 | 주사부위압통, 주사부위종창, 림프절병증, 오심/구토, 피로, 오한, 발열, 근육통, 두통, 관절통 | 주사부위 압통, 주사부위 통증, 피로, 권태 두통, 오심, 구토, 근육통, 관절통 | 주사부위 통증, 두통, 근육통, 관절통, 발열 피로, 오한 | 흔하게 (≥1/100 이고 <1/10) | 주사부위종창, 주사부위홍반, 구토, 설사, 사지통증, 열(발열), 인플루엔자 유사 질병 | 주사부위홍반, 주사부위종창, 발열, 오한, 관절통, 기침 | 주사부위발적 구토, 오심 통증 | 주사부위발적 구토, 오심 통증 | 주사부위홍반, 주사부위두드러기, 주사부위발진, 발진 | 주사부위 발적(홍반포함), 주사부위 부종, 발열, 사지 통증 | 오심/구토, 설사, 주사부위 발적, 주사부위 종창 | 흔하지 않게 (≥1/1,000 이고 <1/100) | 림프절병증, 복통, 식욕감소, 어지러움, 졸림, 다한증, 소양증, 발진, 두드러기 | 발진, 다한증,
무력증, 권태,
근육쇠약, 사지통증, 등통증, 진전, 재채기, 구인두통증, 지각이상, 어지러움, 설사 | 주사부위소양증, 주사부위온감, 주사부위부종, 주사부위홍반, 림프절비대, 상복부통증, 불면, 사지통증, 권태, 무력증, 코막힘, 발진, 인플루엔자 유사증상, 식욕감퇴, 등허리 통증, 기면, 근골격경직, 어지러움, 구인두통증, 다한증, 야간발한 | 주사부위소양증, 주사부위온감, 주사부위부종, 주사부위홍반, 림프절비대, 상복부통증, 불면증, 사지통증, 권태, 무력증, 코막힘, 발진, 인플루엔자 유사증상, 식욕감퇴, 등허리 통증, 근골격경직, 어지러움, 기면, 구인두통증, 다한증, 야간발한 | 주사부위소양증 | 주사부위 소양증, 오한, 통증,
소양증, 림프절 비대, 인플루엔자 유사증상 | 어지러움, 지각이상, 사지통증, 주사부위 소양증, 주사부위 온감, 통증, 흉통, 발진, 구인두 통증, 기침, 두근거림, | 드물게 (≥1/10,000 이고 <1/1,000) | | 과민증, 두드러기, 감각저하, 정맥 혈전색전증, 이명, 구토, 림프절병증, 정맥혈전 색전증 | 급성말초 안면마비 | 급성말초 안면마비 | 급성말초 안면마비 안면종창 | | 림프절병증, 감각저하, 복통, 소화불량, 등허리 통증, 서혜부 통증, 무력증, 소양증, 다한증, 상기도 감염, 멜라닌 세포 모반 | 매우 드물게 (<1/10,000) | 혈소판감소성 혈전증(TTS), 혈소판 감소증, 길랭-바레증후군 | 혈소판감소성 혈전증(TTS),, 길랭-바레 증후군 | | 심근염, 심낭염 | 심근염, 심낭염 | | | 빈도 불명 | 아나필락시스 과민증, 혈관부종, 모세혈관 누출 증후군, 뇌혈관 정맥 및 정맥동 혈전증, 면역혈소판 감소증, 횡단성척수염 | 아나필락시스, 모세혈관 누출 증후군, 면역 혈소판 감소증, 횡단성 척수염 | 아나필락시스, 과민증 | 아나필락시스; 과민증 | 아나필락시스, 과민증 | 아나필락시스, 과민증 | 아나필락시스, 과민증 | 안전성 서한항목1) | 길랭-바레증후군 | 길랭-바레 증후군 | 심근염/심낭염 | 심근염/심낭염 | 심근염/심낭염 | | | 국외 안전성평가 | 길랭-바레증후군2) 횡단성척수염4) | 길랭-바레증후군3) 횡단성척수염4 피부소혈관염7) | | | | 심근염/심낭염5) 아나필락시스6) 감각이상/감각저하6) | |
1) 국내 식품의약품안전처의 안전성 서한( 아스트라제네카 길랭-바레증후군 7.27, 얀센 길랭-바레 증후군 7.27, mRNA 백신 심근염심낭염 6.25) 2) 유럽 EMA 약물감시위험평가위원회(PRAC)의 아스트라제네카백식과 길랭-바레증후군간 인과관계가 합리적인 가능성으로 간주됨에 따라 제품정보에 추가(9.8) 3) 미국 FDA의 얀센백신 긴급사용승인정보 개정(7.13)(연관성은 미확인) 4) 유럽 EMA 약물감시위험평가위원회(PRAC)에서 아스트라제네카 및 얀센 백신의 제품안내서에 횡단성척수염 추가 권고(22.1.14) 5) 미국 FDA 백신자문위원회, 안전성 연구 결과 심근염 및 심낭염 발생이 확인되어 백신과 인과관계 확인 필요 발표(’22.6.7.), EMA에서 제품설명서에 등록 권고(‘22.8.3.) 6) 유럽 EMA 약물감시위험평가위원회(PRAC)에서 노바백스 제품설명서에 등록 권고(’22.7.13.) 7) 유럽 EMA 약물감시위험평가위원회(PRAC)에서 얀센 제품설명서에 등록 권고(‘22.3.17.)
|





